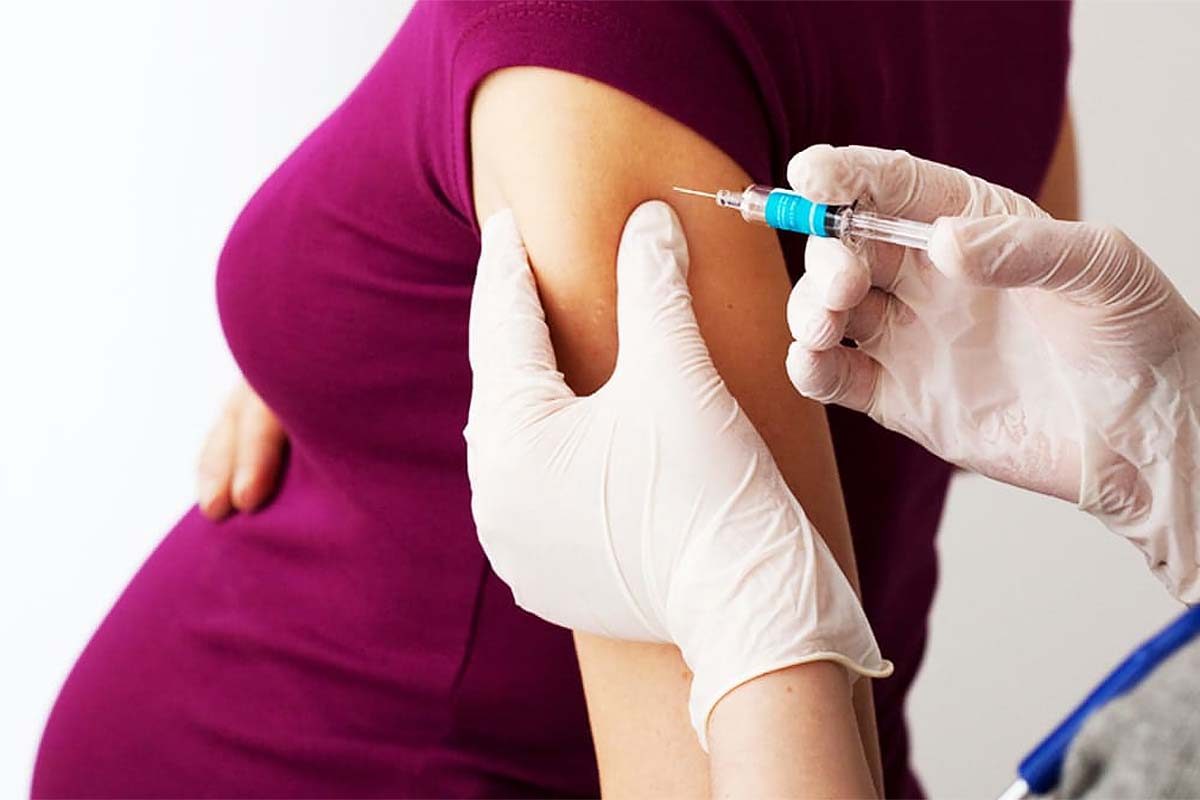
Estados Unidos se convirtió este lunes en el primer país en aprobar una vacuna para embarazadas que previene la bronquiolitis en sus bebés.
La vacuna del gigante farmacéutico Pfizer ha recibido luz verde para su uso entre las semanas 32 y 36 de gestación, con el fin de proteger a los bebés del virus respiratorio sincitial (VRS), informó la Administración de Alimentos y Medicamentos (FDA).
Se trata de una inyección única que se administra en un músculo.
Los bebés estarán protegidos durante los seis primeros meses de vida, explica la FDA.
La misma vacuna está autorizada desde mayo en Estados Unidos para personas mayores de 60 años.
También fue aprobada en julio por la Agencia Europea del Medicamento (EMA), tanto para bebés como para personas de la tercera edad, pero la Comisión Europea debe decidir ahora si aprueba su comercialización en la Unión Europea.
Este virus «es una causa común de enfermedad en los niños, y los lactantes se encuentran entre los que corren más riesgo de sufrir una enfermedad grave, lo que puede llevar a la hospitalización», recordó Peter Marks, director del Centro de Evaluación e Investigación Biológica de la FDA.
El ensayo clínico, en el que participaron unas 7.000 embarazadas, demostró que la vacuna, denominada Abrysvo, reducía la variante grave de la enfermedad en 82% en los bebés de 0 a 3 meses y en un 69% de 0 a 6 meses.
El VRS suele causar síntomas leves como los de un resfriado en lactantes y niños pequeños, pero también neumonía y bronquiolitis.
Se calcula que entre 58.000 y 80.000 niños de menos de cinco años son hospitalizados debido a una infección por VRS, según los Centros para el Control y la Prevención de Enfermedades (CDC), lo que la convierte en la principal causa de hospitalización entre los lactantes.
Entre los efectos secundarios más frecuentes en las embarazadas vacunadas con Abrysvo figuran molestias en el lugar de la inyección, dolor de cabeza o muscular y náuseas.
Un peligroso trastorno de la tensión arterial, conocido como preeclampsia, se produjo en el 1,8% de los casos frente al 1,4% de las que recibieron un placebo.
La FDA observó además un desequilibrio en los nacimientos prematuros entre el grupo que recibió la vacuna y el del placebo (5,7% frente a 4,7%).
Como consecuencia la agencia ha pedido a Pfizer que siga estudiando el riesgo de parto prematuro y preeclampsia.
Tras la aprobación, el producto debe recibir el visto bueno de los CDC, de modo que no está claro si estará disponible a tiempo para la temporada de VRS de este otoño e invierno.
Pero los padres pueden recurrir a otro medicamento aprobado este mes con anticuerpos llamado Beyfortus.
El periodismo independiente necesita del apoyo de sus lectores para continuar y garantizar que las noticias incómodas que no quieren que leas, sigan estando a tu alcance. ¡Hoy, con tu apoyo, seguiremos trabajando arduamente por un periodismo libre de censuras!
Apoya a El Nacional







